CANNABIS TERAPEUTICA
L’uso della cannabis in medicina, come per molti altri principi attivi di origine naturale, è molto antico; se ne ritrova un uso per la cura di diverse patologie in Cina, in India, tra gli indiani d’America . Questo uso, come per tutte le piante, non è stato documentato fino all’inizio del secolo scorso.

Nel corso del XIX secolo la medicina occidentale la adottò ufficialmente come farmaco per la sua efficacia antiemetica, analgesica e anticonvulsiva.
Agli inizi del XX secolo, tuttavia, una serie di circostanze storico politiche portò ad un generale mutamento del clima intorno alla cannabis, a cominciare dagli Usa e a seguire in Europa.
Nel 1942 negli Stati Uniti il Marihuana Tax Act diede il via al proibizionismo nei confronti del commercio, dell’uso e della coltivazione della canapa; negli anni seguenti molti altri stati seguirono la stessa strada.
Anche in Italia, dove nel XIX era iniziato lo studio scientifico per un possibile uso medico, a seguito delle leggi restrittive emanate durante il regime fascista l’uso della cannabis venne bandito rendendo impossibile la prosecuzione degli studi.
Questa situazione è perdurata fino agli anni ’80. In quegli anni sono stati identificati all’interno del nostro organismo i target molecolari dei principi attivi presenti nella cannabis. Ciò ha portato ad un importante sviluppo della ricerca farmacologica fino ad arrivare all’attuale situazione di una maggiore conoscenza del possibile uso dei cannabinoidi in medicina.
Nel 1990 iniziarono negli USA i primi studi sull’uso della cannabis nella sclerosi multipla e per il dolore oncologico.
Nel 1996 nello stato della California venne sancita per la prima volta, tramite un referendum, la liceità dell’uso terapeutico .
Successivamente iniziarono le prime legalizzazioni dell’uso medico della cannabis nel resto del mondo: in Israele nel 2000, in Olanda nel 2003, in Svizzera nel 2011, in Cecoslovacchia nel 2013, in Australia nel 2016 e in Germania nel 2017.
Solo nel 2018 la World Health Organization ha riconosciuto definitivamente l’uso terapeutico della cannabis.
In Europa l’uso medico della cannabis è regolamentato sia dall’EMA (European Medicines Agency) sia dalle normative specifiche dei singoli stati.
L’agenzia EMA ha approvato due farmaci il Sativex (THC + CBD) e l’Epidyolex (CBD) che hanno specifiche indicazioni in determinate patologie (sclerosi multipla il Sativex e l’Epidyolex nell’epilessia, in particolare nella Lennox-Gastaut e Dravet).
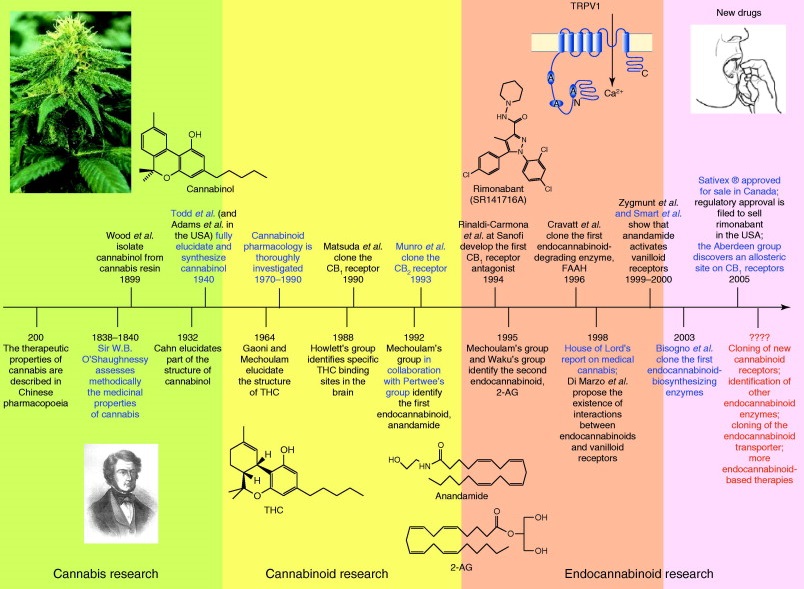
Quando si parla degli effetti farmacologici della cannabis bisogna distinguere tra i cannabinoidi estratti dalla cannabis sativa in preparazioni delle industrie farmaceutiche, prodotti che sono considerabili dei veri e propri farmaci in quanto testati sull’uomo e sugli animali e di cui si conoscono bene tutti gli effetti farmacologici, dai cannabinoidi per uso medico, che sono degli estratti prodotti dai farmacisti nelle loro preparazioni magistrali che hanno un uso medico approvato ma non una standardizzazione precisa delle componenti.
Nel primo caso vi è la evidenza della efficacia ed un controllo sui processi di lavorazione e sul quantitativo di principio attivo presente, nel caso della cannabis per uso medico prodotta dai farmacisti i controlli sono meno rigorosi così come la certezza delle quantità di principio attivo presente.
Sono inoltre in commercio prodotti a base di cannabis che non possono essere venduti per uso medico e che in Italia per legge possono avere un contenuto massimo del 0,2% di THC e vengono quindi chiamati “cannabis light“.
Questi prodotti, venduti in negozi specializzati o su internet, contengono quantità imprecisate di sostanze psicoattive e non si ha pertanto alcuna evidenza della loro efficacia perché non è possibile sapere precisamente quali siano le sostanze presenti e in quali concentrazioni e non possono quindi essere considerati prodotti con effetto farmacologico.
In molti studi effettuati sulla cannabis light si è accertato che solo alcuni di questi prodotti contenevano la quantità dichiarata di CBD, nell’80% dei casi la quantità era inferiore e alcune volte anche maggiore.
Anche per quanto riguarda la percentuale di THC , che dovrebbe essere non superiore al 2%, frequentemente è stata ritrovata in percentuali maggiori, anche fino al 6% . La presenza di quantitativi di CBD e THC non standardizzati sottopone l’assuntore a possibili rischi sia di salute che medico legali.
Le preparazioni a base di cannabinoidi hanno diverse vie di somministrazione e diversi quantitativi di THC e CBD assimilabili.
In Italia dal 2006 i medici possono prescrivere preparazioni magistrali prodotte utilizzando Dronabinol che è una variante stereochinica del delta-9-THC
Il Dronabinol è un prodotto della Unimed Pharmaceuticals, Inc. ed è commercializzato negli Stati Uniti come Marinol, ma è disponibile anche nell’ Unione Europea come farmaco generico.
Il farmaco è registrato, a partire dal 1985 per il trattamento della nausea e del vomito nei pazienti in chemioterapia antitumorale e per la stimolazione dell’appetito nei pazienti con sindrome da deperimento da AIDS.
Il Marinol, prodotto sotto forma di compresse, non è in commercio in Italia.
Dal 2013 in Italia è anche prescrivibile dai neurologi il Sativex (Nabiximols) , il cui principio attivo è una preparazione vegetale costituita da una miscela di due estratti della Cannabis sativa, il cannabidiolo (CBD) e delta9tetraidrocannabinolo (THC) ed è registrato come medicinale per ridurre gli spasmi dolorosi nella sclerosi multipla.
Il Sativex è l’unico farmaco cannabinoide autorizzato all’immissione in commercio in Italia (con determinazione
dell’AIFA pubblicata sul supplemento n°33 alla Gazzetta Ufficiale del 30 aprile 2013).
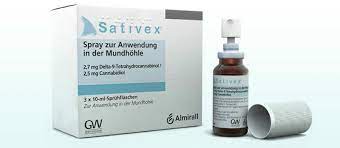
Ogni ml di prodotto contiene: 38–44 mg e
35–42 mg di due estratti (estratti molli) della
Cannabis sativa L., folium cum flore (foglie e
fiori di cannabis) corrispondenti a 27 mg di
delta–9–tetraidrocannabinolo e a 25 mg di
cannabidiolo.
100 microlitri (un puff) contengono 2,7 mg di
delta–9–tetraidrocannabinolo (THC) e 2,5
mg di cannabidiolo (CBD) e fino a 0,04 g di
alcol.
Nel 2016, l’Italia ha avviato la produzione di cannabis per uso medico presso lo stabilimento chimico farmaceutico militare di Firenze (SCFM) gestito in collaborazione tra il Ministero della salute e il Ministero della difesa.
Si tratta del prodotto Cannabis FM-2 (contenente THC 5% – 8% e CBD 7,5% – 12%), prima sostanza attiva a base di cannabis prodotta in conformità alle direttive europee in materia di medicinali (EU – GMP) su processo produttivo depositato e controllato, in una officina farmaceutica autorizzata dall’AIFA.
Dal luglio 2018 è disponibile anche la varietà Cannabis FM-1 (contenente THC 13,0-20,0%; CBD<1%).
.
